Массовая доля показывает процентное отношение массы растворенного вещества к общей массе раствора, %:
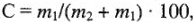
где 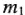 — масса растворенного вещества, г;
— масса растворенного вещества, г; 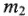 — масса растворителя, г.
— масса растворителя, г.
Для некоторых веществ (кислот, солей, щелочей) можно найти значения С в справочниках по плотности раствора (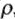 , г/мл).
, г/мл).
Молярная концентрация, или молярность (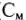 или М) показывает количество молекул растворенного вещества (моль) в 1 л раствора:
или М) показывает количество молекул растворенного вещества (моль) в 1 л раствора:
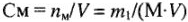
где n — количество растворенного вещества, моль; V — объем раствора, л; М — молярная масса растворенного вещества, г/моль. Можно записать для одномолярного раствора серной кислоты
См = 1 моль/л или 1М. В 1 л 1М раствора содержится 98 г серной кислоты.
Молярная концентрация эквивалента или нормальность (Си или н) показывает количество молярных масс эквивалентов растворенного вещества (в молях), содержащихся в 1 л раствора (моль/л):
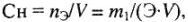
где 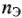 — количество молярных масс эквивалентов растворенного вещества, г/моль; Э — молярная масса эквивалентов растворенного вещества, г/моль. Вместо обозначения единиц молярной концентрации эквивалента в моль/л допускалось сокращение н. Теперь вместо 1н серной кислоты используется выражение: раствор серной кислоты концентрации 0,1 моль/л, т.е. в 1 л такого раствора содержится 1 моль эквивалентов серной кислоты (1 моль
— количество молярных масс эквивалентов растворенного вещества, г/моль; Э — молярная масса эквивалентов растворенного вещества, г/моль. Вместо обозначения единиц молярной концентрации эквивалента в моль/л допускалось сокращение н. Теперь вместо 1н серной кислоты используется выражение: раствор серной кислоты концентрации 0,1 моль/л, т.е. в 1 л такого раствора содержится 1 моль эквивалентов серной кислоты (1 моль 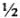 молекулы серной кислоты), или 49 г серной кислоты в 1 л раствора. Этот способ выражения концентрации раствора называют эквивалентной концентрацией, или молярной концентрацией эквивалента.
молекулы серной кислоты), или 49 г серной кислоты в 1 л раствора. Этот способ выражения концентрации раствора называют эквивалентной концентрацией, или молярной концентрацией эквивалента.
 . — обозначим через Сн — рациональный способ выражения концентрации раствора:
. — обозначим через Сн — рациональный способ выражения концентрации раствора:
1) из соотношения (4) следует, что растворы одинаковой молярной концентрации эквивалента реагируют друг с другом равными объемами (удобно пользоваться на практике);
2) соотношение (4) используют для расчетов, связанных с приготовлением разбавленных растворов из концентрированных.
На практике бывает необходимость в переводе одного способа выражения концентрации растворов в другой:
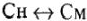
Математические выражения Сн и См:
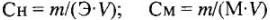
Учитывая, что для одного и того же раствора массы растворенного вещества (m) и объемы (V) равны, получим:
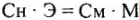
Отсюда 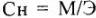 , и, принимая во внимание
, и, принимая во внимание 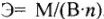 , получим:
, получим: 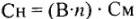
Выводы.
- Сн = См для растворов
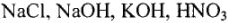 и т.п. (У этих веществ
и т.п. (У этих веществ 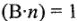 , т.е. Э = М.)
, т.е. Э = М.) - Молярная концентрация эквивалента раствора всегда больше молярной концентрации вещества в (
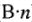 ) раз (за исключением растворов веществ, отмеченных выше).
) раз (за исключением растворов веществ, отмеченных выше).
Результаты расчетов по переводу приведены в табл. 4.
Таблица 4
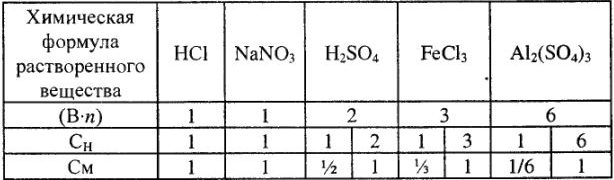
При переводе 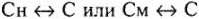 необходимо учитывать плотность раствора.
необходимо учитывать плотность раствора.
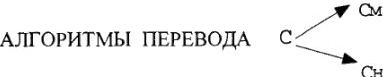
Определяем:
1) массу 1л раствора с плотностью 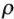 , г по формуле:
, г по формуле:
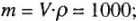
2) массу растворенного вещества в 1 л раствора, г, концентрация которого С, %:
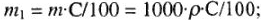
3) количество растворенного вещества в 1 л раствора См, моль/л:
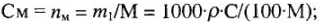
4) количество вещества эквивалентов растворенного вещества в 1л раствора Сн, моль/л:
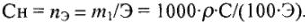
Более рационально для определения молярной концентрации эквивалента использовать формулу:
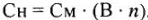
Примечание. При изучении темы «Химические эквиваленты веществ» следует иметь в виду, что в учебной литературе по общей химии нет четкой терминологии и единой формы записи таких понятий, как эквивалент, эквивалентная масса, нормальная концентрация. В методических указаниях использованы термины и форма записи, наиболее распространенные в учебной литературе и более простые для восприятия.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Электролиз расплавов в химии |
| Электролиз водных растворов в химии |
| Полимеры: органические соединения |
| Эквиваленты и количество эквивалентов простых и сложных веществ. Закон эквивалентов |
