Оглавление:
Моль — количество вещества (n), в котором содержится число структурных частиц (молекул, атомов, ионов и др.), равное постоянной Авогадро (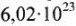 ). При использовании моля как единицы количества вещества следует указывать вид частиц.
). При использовании моля как единицы количества вещества следует указывать вид частиц.
Например:  = 2 моль — количество вещества, содержащего
= 2 моль — количество вещества, содержащего 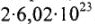 молекул
молекул 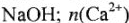 = 0,5 моль — количество вещества, содержащего
= 0,5 моль — количество вещества, содержащего 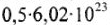 ионов
ионов 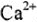 .
.
Молярная масса (М) — масса 1 моля вещества, численно равная его относительной молекулярной (атомной) массе. При использовании термина «молярная масса» также рекомендуется указывать вид частицы, молярная масса которой определяется.
Например, 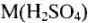 = 98 г/моль — молярная масса молекулы серной кислоты, М(О) — 16 г/моль — молярная масса атомов кислорода. Молярную массу находят как отношение массы (m) вещества к его количеству (и) моль:
= 98 г/моль — молярная масса молекулы серной кислоты, М(О) — 16 г/моль — молярная масса атомов кислорода. Молярную массу находят как отношение массы (m) вещества к его количеству (и) моль: 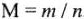 .
.
Обозначения и числовые значения некоторых терминов, а также элементарные расчеты приведены в табл. 1.
Молярная масса эквивалента (Э) — масса 1 моля эквивалента.
В химии большое практическое значение имеют такие характеристики элементов (для атомов) или веществ (для молекул), как эквиваленты, или молярная масса эквивалента.
Эквивалент — такое реальное количество вещества, которое присоединяет или замещает 1 моль атомов водорода в химических реакциях. Эквиваленты выражаются в молях, а молярная масса эквивалента — в г/моль.
Таблица 1
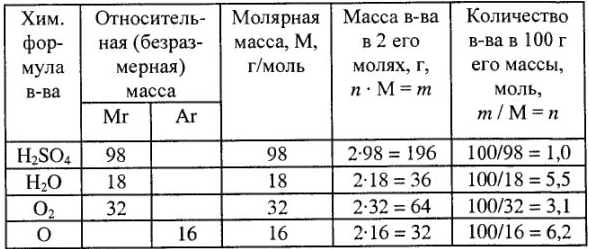
Различают молярные массы эквивалентов элементов, простых и сложных веществ. Молярные массы рассчитывают по формулам:
элементов: 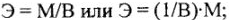
простых и сложных веществ: 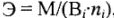
где Э — молярная масса эквивалента, г/моль; М — молярная масса, г/моль; 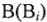 — валентность элемента (заряд катиона или аниона);
— валентность элемента (заряд катиона или аниона); 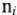 — число элемента (катионов или анионов) в молекуле;
— число элемента (катионов или анионов) в молекуле; 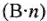 -суммарная валентность элемента (суммарный заряд катионов или анионов в молекуле).
-суммарная валентность элемента (суммарный заряд катионов или анионов в молекуле).
Молярная масса эквивалента элемента в соединениях определяется делением молярной массы его атомов на валентность. Молярная масса численно равна его относительной атомной массе: 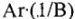 — число, показывающее, какая часть моля эквивалентна 1 молю атомарного водорода. Её называют фактором эквивалентности и обозначают
— число, показывающее, какая часть моля эквивалентна 1 молю атомарного водорода. Её называют фактором эквивалентности и обозначают 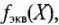 , где X — символ элемента. Например,
, где X — символ элемента. Например, 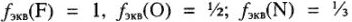 (в соединениях
(в соединениях 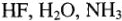 ).
).
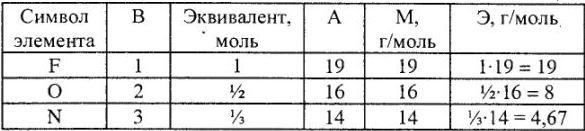
Определение эквивалента и эквивалентной массы элементов фтора, кислорода, азота в соединениях  показано в табл. 2.
показано в табл. 2.
Таблица 2
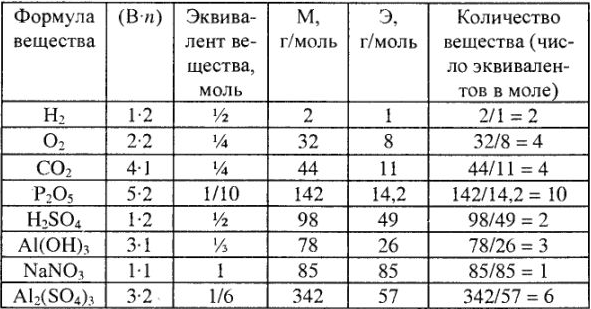
Эквивалентные массы простых веществ равны их молярной массе, деленной на суммарную валентность атомов (В-n).
Молярные массы эквивалентов кислот, оснований и солей в реакциях обмена выражаются через молярную массу, деленную на произведение абсолютного значения заряда одного из ионов на число их в соединениях. Причем молярная масса эквивалента кислоты равна ее молярной массе, деленной на ее основность в реакции (число водородных ионов, участвующих в химической реакции), а молярная масса основания — молярной массе, деленной на кислотность основания в реакции (число гидроксильных групп, принимающих участие в химической реакции).
Расчет эквивалентов, молярные массы эквивалентов и число эквивалентов в молярной массе для простых и сложных веществ приведены в табл. 3.
Таблица 3
Обратите внимание: число эквивалентов (молярная масса эквивалентов) в моле (молярной массе) вещества равно (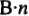 ), т.е. суммарной валентности элемента (зарядности иона). Эквивалент — часть моля (в частном случае эквивалент равен нулю). 1/(
), т.е. суммарной валентности элемента (зарядности иона). Эквивалент — часть моля (в частном случае эквивалент равен нулю). 1/(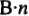 ) — фактор эквивалентности;
) — фактор эквивалентности; 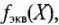 показывает, какую часть моля составляет эквивалент.
показывает, какую часть моля составляет эквивалент.
Молярный объем — объем, занимаемый молярной массой газообразного вещества. Молярный объем любого газа при нормальных условиях равен 22,4 л.
Эквивалентный объем — объем, занимаемый молярной массой эквивалента газообразного вещества. 1 моль водорода содержит 2 эквивалента. Объем молярной массы эквивалента водорода (1г/моль) — 22,4/2 = 11,2 л. 1 моль кислорода содержит 4 эквивалента. Объем молярной массы эквивалента кислорода (8г/моль) 22,4/4 = 5,6 л.
Закон эквивалентов
Отношения масс (объемов) реагирующих друг с другом веществ равны или пропорциональны их химическим эквивалентным массам (эквивалентным объемам).
Математические выражения закона эквивалентов:
а) для любых веществ с известной массой:
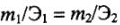
б) для газов с известным объемом:
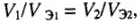
где 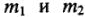 — массы реагирующих веществ;
— массы реагирующих веществ; 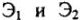 — их химические эквиваленты;
— их химические эквиваленты; 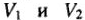 — объемы реагирующих газообразных веществ;
— объемы реагирующих газообразных веществ; 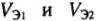 — объемы эквивалентных молярных масс.
— объемы эквивалентных молярных масс.
Следствие закона эквивалентов
Вещества реагируют друг с другом равным числом эквивалентов (молярных масс эквивалентов).
Математические выражения следствия закона эквивалентов:
а) для любых веществ с известным количеством эквивалентов (эквивалентных масс):
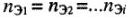
б) для растворов с известной молярной концентрацией эквивалента:
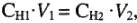
где 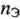 — количество эквивалентов вещества;
— количество эквивалентов вещества; 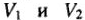 — объемы растворов веществ, реагирующих друг с другом;
— объемы растворов веществ, реагирующих друг с другом; 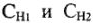 -молярная концентрация эквивалента этих растворов (нормальность раствора).
-молярная концентрация эквивалента этих растворов (нормальность раствора).
Рациональное решение задач сводиться к правильному выбору формулы из 1-4. При необходимости можно приравнять левую часть одного из приведенных уравнений к правой части любого другого.
Например, для решения реакции взаимодействия твердого вещества с раствором определенной молярной концентрации эквивалента (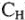 ) имеем уравнение:
) имеем уравнение:
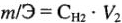
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:

