Оглавление:
Получение и химические свойства металлов
Задача 66.
Используя справочные данные по 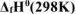 и
и 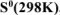 , определить температурную границу возможного технического использования карботермического процесса:
, определить температурную границу возможного технического использования карботермического процесса: 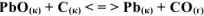
Записать выражение для константы равновесия 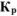

Решение:
Приведенный процесс будет возможен, когда равновесное давление оксида углерода (II) будет равно наружному давлению или превышать его, т.е. 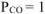
Поскольку 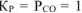 , то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
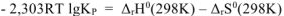
Так как 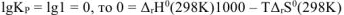
Откуда 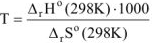
где 1000 — коэффициент перевода кДж в Дж
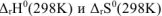 определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
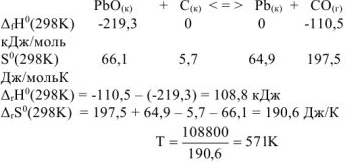
Ответ: процесс возможен при нагревании начиная с Т = 571К
Задача 67.
Вычислить массовую долю оксида цинка в смеси с цинком, если при взаимодействии 7,27 г смеси с водным раствором щелочи выделилось 1,12 л водорода (н.у.).

Решение:
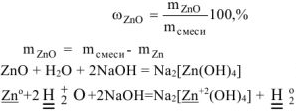

Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции (12.3):
Составляем пропорцию:
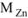 вытеснит 22,4 л
вытеснит 22,4 л 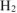

где 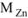 = 65,4 г/моль
= 65,4 г/моль
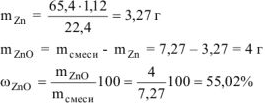
Ответ: 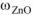 =55,02%.
=55,02%.
Задача 68.
Используя значения стандартных электродных потенциалов, рассчитать константу равновесия в реакции цементации, протекающей при стандартных условиях.
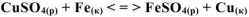

Решение:
Записываем реакцию в ионно-молекулярном виде:
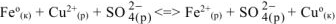 — полное ионно-молекулярное уравнение
— полное ионно-молекулярное уравнение
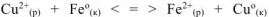 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение

 — стандартное напряжение этой реакции
— стандартное напряжение этой реакции
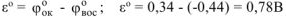
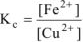
Так как приведенная реакция является окислительно-восстановительной, то:
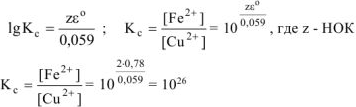
Ответ: 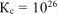 . Высокое значение
. Высокое значение 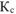 свидетельствует о практически полном смещении равновесия вправо.
свидетельствует о практически полном смещении равновесия вправо.
Задача 69.
На 2 г смеси, состоящей из 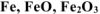 подействовали хлороводородной кислотой. При этом выделилось 224
подействовали хлороводородной кислотой. При этом выделилось 224  (при и.у.) водорода, а при восстановлении 2 г исходной смеси до металла водородом получено 0,45 г воды. Определить состав исходной смеси (% масс.).
(при и.у.) водорода, а при восстановлении 2 г исходной смеси до металла водородом получено 0,45 г воды. Определить состав исходной смеси (% масс.).

Решение:
При взаимодействии смеси с хлороводородной кислотой протекают реакции:
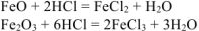
Водород выделяется лишь за счет реакции:
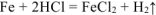
Составляем пропорцию для реакции (12.6):
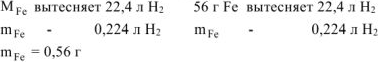
где 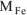 =56 г/моль масса оксидов равна:
=56 г/моль масса оксидов равна: 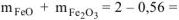 = l,44 г
= l,44 г
При восстановлении смеси 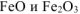 водородом протекают реакции
водородом протекают реакции
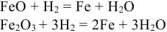
Составляем пропорцию для уравнения (12.7)
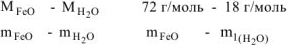
Откуда 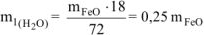
Составляем пропорцию для уравнения (12.8)
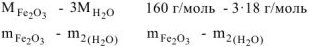
Откуда 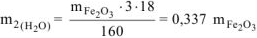
По условию задачи
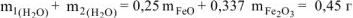
Составляем систему уравнений
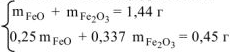
Выражаем из первого уравнения 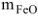
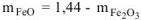 и подставляем во второе уравнение
и подставляем во второе уравнение
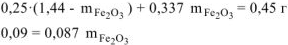
Откуда 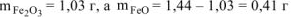
Определяем состав исходной смеси:
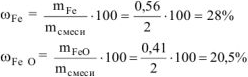
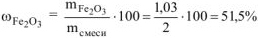
Ответ: состав смеси: 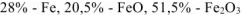
Задача 70.
Составить схему получения металлического кадмия из 10 г смеси оксидов 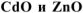 . В качестве растворителя оксидов использовать разбавленную серную кислоту. Определить состав смеси (% мае.) и массу полученного кадмия, если в качестве восстановителя
. В качестве растворителя оксидов использовать разбавленную серную кислоту. Определить состав смеси (% мае.) и массу полученного кадмия, если в качестве восстановителя 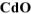 использовали
использовали 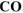 , а объем образовавшегося
, а объем образовавшегося 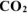 составляет 300
составляет 300 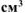 (н.у.)
(н.у.)

Решение:
Составляем схему разделения оксидов и записываем уравнения реакций по стадиям:
1. Растворение оксидов кадмия и цинка в 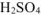 :
:
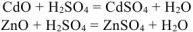
2. Осаждение гидроксидов кадмия и цинка гидроксидом натрия при стехиометрическом соотношении солей и гидроксида натрия:
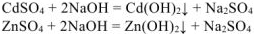
3. Растворение амфотерного гидроксида цинка в избытке щелочи:
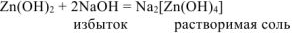
Так как 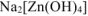 — растворимая соль, то в осадке остается только гидроксид кадмия.
— растворимая соль, то в осадке остается только гидроксид кадмия.
4. Отделение осадка 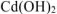 от раствора фильтрацией, промывка, сушка.
от раствора фильтрацией, промывка, сушка.
5. Разложение осадка 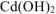 при нагревании:
при нагревании:
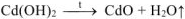
6. Восстановление 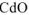 оксидом углерода (II) при нагревании:
оксидом углерода (II) при нагревании:
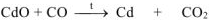
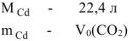
откуда 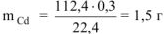
где 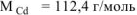
Определяем содержание 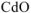 в смеси по уравнению (12.16)
в смеси по уравнению (12.16)

где 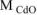 = 128,4 г/моль,
= 128,4 г/моль,
откуда 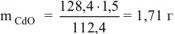
Определяем 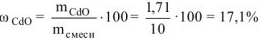
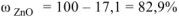
Ответ: состав смеси 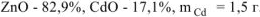 .
.
Задача 71.
При растворении 0,5 г алюминиевой бронзы, состоящей из меди и алюминия, в хлороводородной кислоте выделилось 43,56 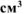 водорода, собранного над водой и измеренного при 300К и 740 мм рт. ст. Давление паров воды при 300К равно 26,74 мм рт. ст. Определить состав сплава (% мас.)
водорода, собранного над водой и измеренного при 300К и 740 мм рт. ст. Давление паров воды при 300К равно 26,74 мм рт. ст. Определить состав сплава (% мас.)


Решение:
В соответствии со следствием из ряда стандартных электродных потенциалов металлов в хлороводородной кислоте могут растворяться только те металлы, у которых
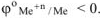
Определяем стандартные электродные потенциалы:
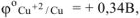
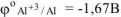
Следовательно, в хлороводородной кислоте из сплава будет растворяться только алюминий.
Уравнение реакции имеет вид:
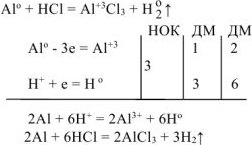
ДМ удваиваем, т.к. после реакции образуется четное число атомов водорода
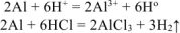
Массу алюминия в сплаве можно рассчитываем по уравнению реакции (12.18):
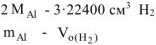
Откуда
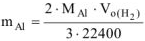
где 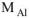 =27 г/моль
=27 г/моль
Объем водорода при н.у. 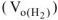 рассчитываем по объединенному уравнению газового состояния:
рассчитываем по объединенному уравнению газового состояния:
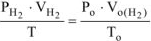
Откуда: 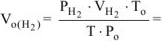
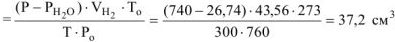
где 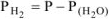
Подставляя величину 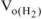 формулу (12.19), получаем:
формулу (12.19), получаем:
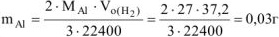
Рассчитываем содержание металлов в сплаве:
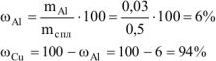
Ответ: состав сплава 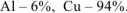 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Гальванические элементы коррозия металлов задачи с решением |
| Электролиз растворов задачи с решением |
| Комплексные соединения задачи с решением |
| Жесткость воды задачи с решением |

