Оглавление:
Растворы сильных и слабых электролитов
Задача 38.
Вычислить pH следующих водных растворов: а) 0,02 М 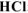 ; б) 0,2 М
; б) 0,2 М 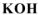

Решение:
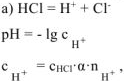
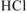 — сильный электролит,
— сильный электролит, 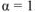 ;
;
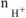 — число
— число 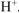 , образовавшихся при диссоциации одной молекулы
, образовавшихся при диссоциации одной молекулы 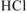 ;
;
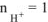 , тогда
, тогда 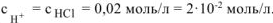
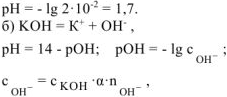
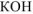 — сильный электролит,
— сильный электролит, 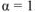 ;
;
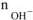 — число
— число 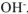 , образовавшихся при диссоциации одной молекулы
, образовавшихся при диссоциации одной молекулы 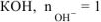 , тогда
, тогда
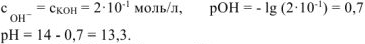
Ответ: 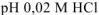 равно 1,7;
равно 1,7;
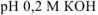 равно 13,3.
равно 13,3.
Задача 39.
Вычислить pH 0 ,05 М водного раствора хлорноватистой кислоты 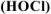 .
.

Решение:
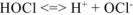
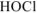 — слабый электролит.
— слабый электролит.
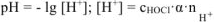
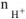
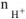 — число
— число 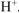 образовавшихся при диссоциации одной молекулы
образовавшихся при диссоциации одной молекулы 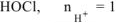 .
.
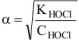
 — константа диссоциации
— константа диссоциации 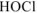 :
:
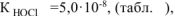
тогда 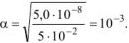
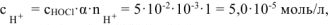
тогда 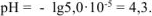
Ответ: 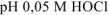 равно 4,3.
равно 4,3.
Задача 40.
Определить произведение растворимости 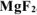 , если его растворимость в воде при 25°С равна
, если его растворимость в воде при 25°С равна 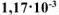 моль/л.
моль/л.

Решение:
Равновесие между осадком малорастворимого электролита и его насыщенным раствором выражается уравнением:
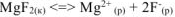
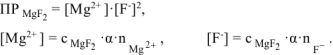
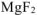 — сильный электролит,
— сильный электролит, 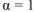 .
.
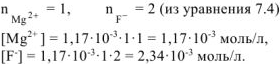
Тогда 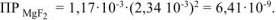
Ответ: 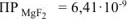
Задача 41.
Рассчитать pH раствора, полученного смешением 25  0,1М раствора
0,1М раствора 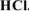 , 20 см3 0,2М раствора
, 20 см3 0,2М раствора 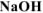 и 50 см3 воды.
и 50 см3 воды.

Решение:
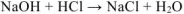
Рассчитываем химическое количество исходных веществ:
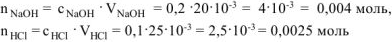
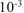 — коэффициент перевода мл в л.
— коэффициент перевода мл в л.
Из уравнения реакции (7.5) следует, что число моль 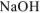 , вступившего в реакцию, равно числу моль
, вступившего в реакцию, равно числу моль 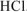 .
.
Определяем вещество, оставшееся в избытке:
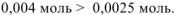
Следовательно, в избытке, который определяет pH среды остался 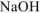 .
.
Тогда количество избыточного 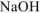 в растворе:
в растворе:
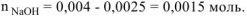
Учитывая, что суммарный объем раствора складывается из объемов двух растворов и воды,
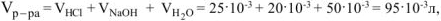
Молярная концентрация  равна:
равна:
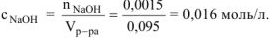
Так как диссоциация  протекает по уравнению:
протекает по уравнению:
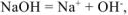 то
то
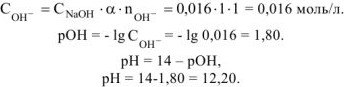
Ответ: pH = 12,20.
Задача 42.
Определить, образуется ли осадок, если смешали 100  0,01М водного раствора хлорида кальция и 200
0,01М водного раствора хлорида кальция и 200  0,02М кого раствора карбоната натрия.
0,02М кого раствора карбоната натрия.

Решение:
При смешении растворов протекает следующая реакция:
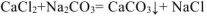
Осадок 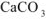 образуется только в случае, если
образуется только в случае, если
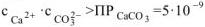 (табл) Поскольку смешали 100
(табл) Поскольку смешали 100  раствора
раствора 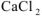 и 200
и 200 
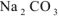 , то объем раствора после смешения составляет 300
, то объем раствора после смешения составляет 300  . После смешения с учетом разбавления растворов концентрации ионов
. После смешения с учетом разбавления растворов концентрации ионов 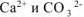 будут равны:
будут равны:
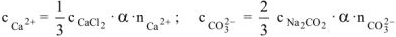
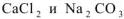 — сильные электролиты,
— сильные электролиты, 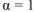 .
.
Процессы диссоциации 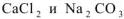 протекают по следующим уравнениям:
протекают по следующим уравнениям:
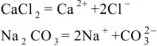
следовательно, 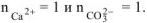 .
.
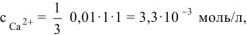
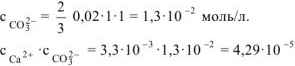
Так как 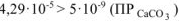 то осадок
то осадок 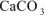 , образуется. Ответ: осадок
, образуется. Ответ: осадок 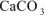 , образуется.
, образуется.
Задача 43.
Вычислить pH 0,01М водного раствора 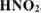 , содержащего, кроме того, 0,02 моль/л
, содержащего, кроме того, 0,02 моль/л 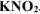 .
.
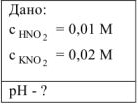
Решение:
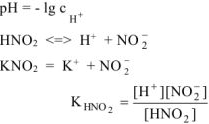
Прибавление 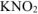 к раствору
к раствору 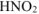 смещает равновесие диссоциации
смещает равновесие диссоциации 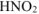 влево за счет увеличения концентрации иона
влево за счет увеличения концентрации иона 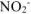 . В результате, в системе устанавливается равновесие при новых концентрациях
. В результате, в системе устанавливается равновесие при новых концентрациях 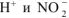 , ио значение константы диссоциации
, ио значение константы диссоциации 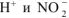 при этом остается прежним.
при этом остается прежним.
Тогда обозначим равновесную концентрацию ионов 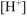 в новых условиях через х:
в новых условиях через х:
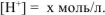
Общая равновесная концентрация иона 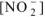 равна сумме
равна сумме
концентраций иона 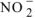 , образовавшегося при диссоциации
, образовавшегося при диссоциации 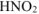 и при диссоциации
и при диссоциации 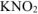 :
:
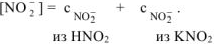
Концентрация ионов 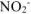 , образовавшихся при диссоциации
, образовавшихся при диссоциации 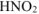 , равна х моль/л, так как при диссоциации 1 моль
, равна х моль/л, так как при диссоциации 1 моль 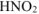 образуется 1 ион
образуется 1 ион 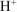 и 1 ион
и 1 ион 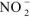 (из уравнения 7.7).
(из уравнения 7.7).
Концентрация ионов 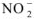 , образовавшихся при диссоциации
, образовавшихся при диссоциации 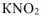 равна:
равна: 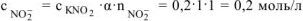 (из уравнения 7.8.),
(из уравнения 7.8.),
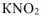 — сильный электролит,
— сильный электролит, 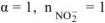 .
.
тогда [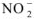 ] = (х + 0,02) моль/л
] = (х + 0,02) моль/л
Равновесная концентрация иедиссоциированных молекул
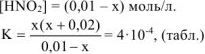
так как, 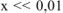 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
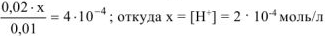
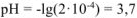
Ответ: pH = 3,7.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:

