Оглавление:





Фазовое равновесие
- При расчете процессов дистилляции и ректификации широко используется принцип фазовых равновесий. Вы рассматривали возможность применения правила фазы для определения числа независимых переменных в вашей системе равновесия 33. Формула (33. Из 1) мы обнаружили, что 2-фазные бинарные системы могут произвольно выбирать 2 переменные. Обычно давление задается в процессе расчета, поэтому в любой двоичной системе достаточно потребовать еще 1 переменную, чтобы определить все остальные переменные в системе. Например, если жидкость кипит в дистилляционном Кубе при давлении 1 атм и содержит 65 моль. Этанола и 35 мол. Так как температура системы газ-жидкость и состав пара строго определены.
Если давление дистилляционной колонны равно 1 атм, а температура жидкости, выходящей из верхней пластины, известна, то в этой бинарной системе состав как пара, так и потока жидкости, выходящего из каждой пластины, определяется заранее, если эти потоки находятся в равновесии. Состав равновесной фазы определяется экспериментально или с использованием различных зависимостей. Ваш 33 мы смотрим на то, как Закон Рауля может быть использован для расчета равновесного состава парожидкостной системы, когда жидкая фаза является идеальным раствором, а газовая фаза-идеальным газом.
Таким образом, источник тепла является своего рода модификацией влияния изменения в нулевой точке. Людмила Фирмаль
Полезным понятием является относительная волатильность. Лето Честь размерности давления выражается относительно компонента а соотношением. (41.1) Для чистых веществ, летучесть равна давлению пара. «Относительная волатильность определяется как (41.2) Компоненты A и B разделенной 2-компонентной смеси представляют собой n AB> 1.In в этом смысле компонент А является наиболее изменчивым из 2.Исходя из определения, данного парциальному давлению-см. формулу (33.2)、 (41-3)) Или, если закон Рауля применим к системе, подставьте уравнение (33.3) в уравнение (41.2) и затем、 Поскольку эта глава ограничена бинарными смесями, обозначение упрощается путем исключения индексов компонентов A и B.
Молярная доля более летучего компонента a пары. И каждый в жидкости обозначен молярной долей y n x, а менее летучие компоненты B—1-y и 1-x. In в этих обозначениях уравнение (41.3) принимает вид: (41.5) (41.6) Эта зависимость используется для ректификации бинарных смесей, особенно если разница в температуре кипения чистых компонентов невелика. В этих условиях относительная изменчивость часто почти постоянна.
Это позволяет построить график зависимости y от x в диапазоне концентраций используйте среднее значение a от 0 до 1.Если бинарная система следует закону Рауля, то a можно вычислить из соотношения давления пара по формуле (41.4).Упругость пара может значительно изменяться в рассматриваемом диапазоне температур, но соотношение упругости пара изменяется значительно меньше. Если жидкая или газовая фазы не ведут себя как идеальный раствор или идеальный газ, относительные летучие вещества могут быть рассчитаны с использованием термодинамики.
Примеры решения и задачи с методическими указаниями
| Решение задач | Лекции |
| Расчёт найти определения | Учебник |
- Термодинамические расчеты проводятся не для непосредственного определения относительной летучести, а для определения величины константы равновесия между паром и жидкостью. (41.7). Значение K может быть использовано для расчета равновесного состава. Наша работа не включает в себя анализ термодинамических расчетов, на основе которых определяется величина K и описывается в большинстве учебников по химической термодинамике. Ключ здесь, чтобы напомнить вам, что K является функцией температуры, давления и в общем случае состава. Значение K приводится во многих источниках, но оно использует только значения, указанные в руководстве по эксплуатации.
Эти значения зависят только от давления и температуры. Поэтому их можно применять только к жидкостям и парам, которые будут выступать в качестве идеала solution. In чтобы получить более точные значения, студенты будут представлены в серии из 276 диаграмм, известных как диаграммы Келлога[83, 36, ’ 43], которые могут быть применены к неполным решениям. Пример 41.1 Создать диаграмму г- Условия: 。Вы можете разрешить 。Использовать преимущества Температура кипения и-Бутана 1к Перри, стр. 564, 2 ингредиента Йод во многих названиях. Адлер и Палаццо [2]имеют распределение волатильности и просто дают краткий обзор уравнения В пределах этих температур будет уравновешиваться только 1,4.
Очевидно, что источники тепла могут быть произвольно распределены по всему телу, это распределение изображается точками при проведении вычисления. Людмила Фирмаль
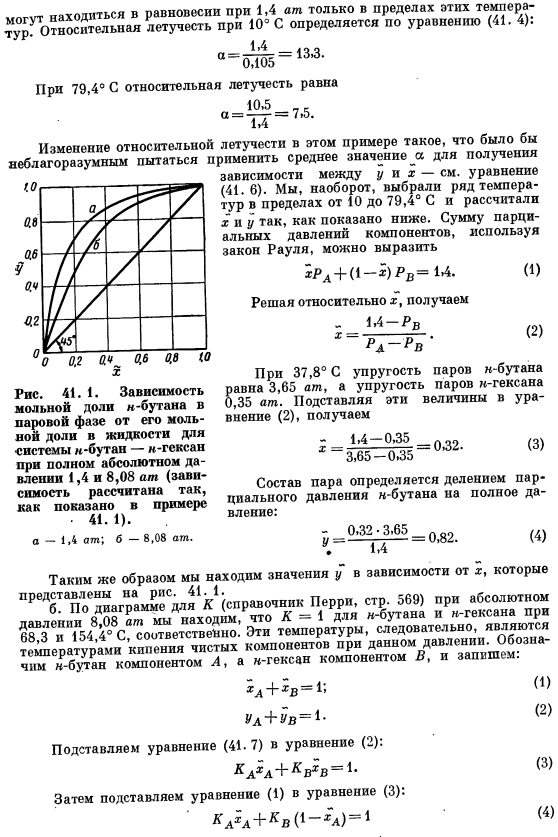
Относительную летучесть при 10°с рассчитывают по формуле (41. 4) определяется по: На 79.4°С、 «Л +» в = 1- Л + хл = 1- Затем подставьте уравнение (3) в уравнение (1). (1) (2) (3) (4 )) ХЛ = 0.54. УА = 1.60-0.54 = 0.86. yA, соответствующий xA, вычисляется аналогично при температуре 68,3-154,4°C и изображается на рисунке. 41.1. Обратите внимание на рисунок. 41. 8.08 1 зависимость y от x от абсолютного давления атм ближе к диагонали квадрата, чем к кривой 1,4 а.
Диагональ квадрата соответствует зависимости Y = x. совпадение кривой равновесия пар-жидкость со 2-й прямой означает, что разделение смеси ректификацией не может быть достигнуто. С другой стороны, кривая равновесия пара и жидкости, находящаяся далеко за диагональю, соответствует случаю, когда может быть достигнуто значительное разделение смеси путем ректификации. Поэтому разделение Н-Бутан — » — смесей гексана легче осуществлять при 1,4 Ат.8.08 утра.
Из этого можно сделать вывод, что при давлении 1,4 атм необходимое количество ступеней будет уменьшено для достижения определенного разделения в дистилляционной колонне или для достижения большой разницы в концентрации паров и жидкостей при одноступенчатой регулярной дистилляции. ‘ Если 2-компонентная смесь образует азеотроп, то зависимость y от x пересекает диагональ. Таким образом, в случае систем этанол-вода, при построении молярной доли парового этанола на основе молярной фракционной зависимости этанола в жидкости, зависимость y от x находится по диагонали от x = 0 до азеотропного состава этанола до 0,894 молярного fraction.
Смотрите также:

