Оглавление:






Теплоемкость двухатомных газов
- В § 37 квантовая теория случая осцилляторов увидела возможность устранить фундаментальные трудности, возникшие в классической теории теплоемкости. Мы можем также дать общий ответ на вопрос о том, какие степени свободы являются существенными для проблемы теплоемкости. То есть для заданной степени свободы, если минимальная энергия равна£, а следующий энергетический уровень равен£, то вероятность состояния E равна _______ > 1) очень велика small.
При этом условии система фактически находится в самом низком энергетическом состоянии, и ее средняя энергия равна е, не зависящей от температуры. Соответствующая теплоемкость будет практически нулевой. Если значения (E,-E«) / k обозначаются Te («характерная температура»), то условием потери теплоемкости является T» Te. Применение квантовой теории к задаче теплоемкости кучи, содержащей двухатомные и многоатомные молекулы, позволяет подробно объяснить как величину, так и температурную зависимость теплоемкости. Здесь мы анализируем проблему удельной теплоты двухатомного газа. Двухатомные молекулы газа должны быть представлены как 2 твердых атома, соединенных друг с другом.
Эта часть энергии становится заметной только при высоких температурах, и ее увеличение объясняет увеличение теплоемкости при высоких температурах. Людмила Фирмаль
Именно поэтому расстояние между ними почти не меняется. Каждый атом можно считать абсолютно жестким, и его местоположение определяется расположением атомного ядра. — £₀Очень большой (порядка 10_ » J), наличие движения электрона в атоме влияет только от температуры порядка* 10000 к. Я видел десятки температурных диапазонов. До нескольких сотен Кельвинов учитывается правильная теплоемкость 2-х атомных молекул Бежать. Рассматривается система с 5 степенями свободы-как 2 плотно связанных материала points. In в этом случае учитываются поступательное движение молекул и вращение вокруг 2 осей, но вращение вокруг оси симметрии и колебание ядер не учитываются account.
Также было установлено, что при высоких температурах (порядка 1000 к) теплоемкость увеличивается и имеет значение большее, чем соответствующее этой модели по классическим theory. In кроме того, для водорода наблюдается снижение теплоемкости при низких температурах(начиная с 300к), а для 50к она падает до величины, соответствующей 3 кал /(моль•к), То есть одноатомного газа. Все эти факты объясняются квантовой теорией. Поступательное движение должно быть учтено, вращение молекулы к колебанию атома nucleus.
В приближении, подходящем для температуры не слишком высокой, можно предположить, что эти движения можно рассматривать независимо друг от друга, и что энергия состоит из поступательной, вращательной и колебательной энергии атома nucleus. So, средняя энергия Е и удельная теплоемкость с состоят из 3 слагаемых. Е = ЕП + Е Н + Е, Б, (38.1) с,= СП + КРС + с, L. (38.2) Что касается энергии поступательного движения молекул, то квантовая теория в нашем случае не дает ничего нового по сравнению с классической one. So, средняя поступательная Энергия 1 молекулы К ней. (38.3) Соответствующая молярная теплоемкость равна= — / — LGy = R»3 cal /(mol-K).
Колебания атомных ядер в молекуле считаются малыми, и их можно считать гармониками(это относится к температурам в несколько тысяч Кельвинов).Средняя колебательная энергия выражается уравнением планка, так что для 1 молекулы Равный (38.5) Молярная теплоемкость (38.6) Где W-собственная частота колебаний. Частота Предопределенный Если спектр излучения (или поглощения) известен Против некоторых gases. In в случае молекулы, состоящей из ионов разного знака, ее колебание сопровождается изменением электрического момента молекулы, что вызывает эмиссию, поэтому ее частота представляется как 1 частота линии эмиссии.
Для молекул, состоящих из одинаковых атомов, частота / 2л = 0.875•10 ″ с-1, что соответствует линии инфракрасного спектра, где L-3,42 мкм. Так, НС1 Tᵥ Что?05-10-м-2л 0,875 10 / < _r В случае H. T. Для n», 6100 K, O, T, ge * = 2240K. температуру T » 1 ″ Lh / L можно назвать характеристической температурой энергии вибрации. T 3> T. Для n можно использовать классическую формулу. Наоборот, TT. T. at p, теплоемкость незначительна.
Приведенные цифры показывают, что для газообразного газа G| b составляет около нескольких тысяч Кельвинов. Это означает, что при комнатной температуре, ниже колебательной энергии молекулы, соответствующая теплоемкость очень мала и не учитывается вообще. Например, для O молярная теплоемкость при 300 К составляет 1b-0,05 кал / (моль-к). Наконец, рассмотрим энергию вращения molecule. In кроме того, при расчете энергии вращения мы считаем молекулу абсолютно rigid. In в этом случае молекула представляет собой симметричное вращающееся тело.
- Получим момент инерции относительно оси симметрии по модели равный 0. Квантовая механика показывает, что энергия вращения такой системы важна (38.7) Где А-момент инерции вокруг оси. Перпендикулярно к оси symmetry. In кроме того, состояния, соответствующие определенным кратным. Его кратность равна 2A / +1.
Обратите внимание, что есть выражение вместо (38.7), когда вы думали, что момент инерции вокруг оси симметрии не равен нулю, но что он не равен нулю и равен B /И я-целые числа、 / −0.1, 2,…; Эта формула показывает, что разность уровней между энергией, соответствующей i-0 и 2-1, очень велика, когда момент инерции B очень мал.То есть мы используем формулу (38.7).другими словами, она оправдывает предположение, что это B = 0.
Таким образом, согласно вышесказанному, вращением вокруг оси симметрии можно пренебречь, предполагая, что молекула всегда находится в состоянии I-0. Людмила Фирмаль
Из квантовой теории точно так же следует, что «вращательная теплоемкость» при низких температурах должна быть очень высокой С,1ii /(maa10 о¡М / ООО /ОО гот р, к Small. In дело в том, что разность между начальным энергетическим уровнем и нулевым энергетическим уровнем составляет L72L, поэтому характерная температура, соответствующая вращению, равна Tm-Kg / 2Ak. Момент инерции молекулы водорода равен а = 0,47 * 10_ и г-см. Отсюда для молекулы H получаем Г» 1 ″ 86k.
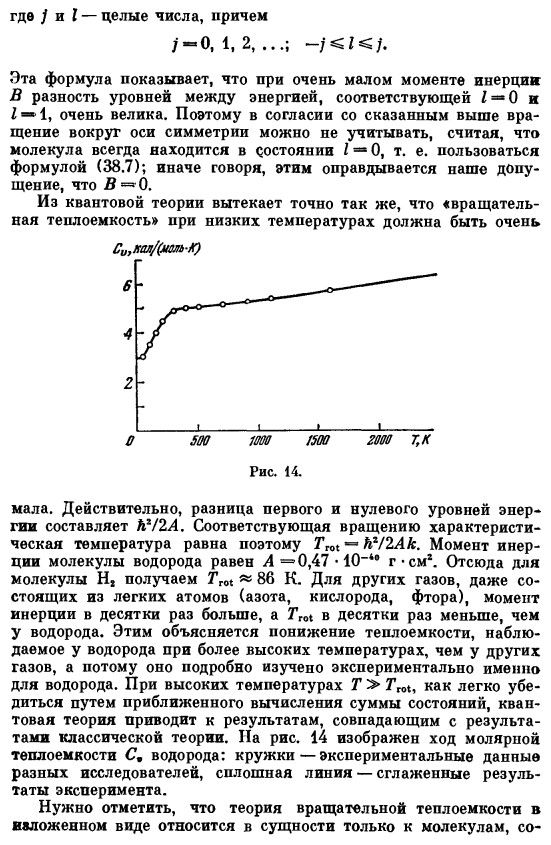
Для других газов, состоящих из легких атомов (азот, кислород, фтор), момент инерции в десятки раз больше, чем у водорода, а Tm в десятки раз больше, чем hydrogen. It подробно исследовано экспериментально для водорода с учетом снижения теплоемкости, наблюдаемого в водороде при температурах выше, чем в других газах. При высокой температуре T> Tgo квантовая теория приводит к результату, совпадающему с классическим, так что его легко проверить приближенным вычислением суммы состояний. На рисунке 14 показан ход молярной теплоемкости © и водорода. Круг-экспериментальные данные различных исследователей, сплошная линия-сглаженные экспериментальные результаты.
Теория вращательной теплоемкости в описанном виде по существу является、 Оно стоит от различного atoms. In чтобы полностью решить задачу, для молекул, состоящих из одинаковых атомов, например, водорода, необходимо учитывать принцип Паули(§§ 45-46).Рассматривая водород, мы приходим к выводу, что молекулярный водород представляет собой смесь 2 типов молекул водорода. Орто-водород ■ пара-водород. Взаимная ориентация ядерных спинов отличается друг от друга*).Только после рассмотрения этой ситуации удалось получить полное количественное согласие теории удельной теплоты водорода при низких температурах путем experiments.
Также удалось обнаружить влияние на теплоемкость катализаторов, которое ускоряет переход водорода из Орто-В пара-состояние(и наоборот) и установление их равновесия. Следует отметить, что в связи с разделением теплоемкости на»поступательную«, «вращательную» и «колебательную», все измерения, связанные с состоянием равновесия (калориметрия, например), а также их сумма всегда являются detected. As мы сделали выше, на основе теоретического анализа результатов, только зная температурную зависимость теплоемкости, ее можно разделить на 3 члена. Разделение теплоемкости на эти термины является лишь приблизительным.
Точная теория, которая количественно объясняет все детали кривой, учитывает, например, изменение момента инерции, вызванное вибрацией. Однако для измерений, которые не сбалансированы, теплоемкость, связанная с вибрацией, может быть отделена от вращения и перемещения. Это относится к определению тепловой мощности от скорости звука в Газе. Как известно, скорость звука в Газе Так, зная скорость звука, можно найти С. Если скорость низкочастотного звука, например слышимого звука, измеряется, то на протяжении всего процесса распределение энергии газа будет примерно таким же, как и в равновесное время, А С будет полной равновесной теплоемкостью.
Однако в очень высокочастотном ультразвуке (например, в случае диоксида углерода с частотой 10 * −10 Гц) возбуждение молекулярной вибрации происходит лишь в малой части столкновения и происходит относительно медленно, поэтому обмен колебательной энергией молекул с поступательной и вращательной энергиями не успевает происходить. occur. In этот случай, от скорости звука [*) В положительных молекулах водорода спин атомного ядра параллелен.- Водородные спины параллельны друг другу.」 Молекулы.* Вместо общей теплоемкости распределяется значение₁₁r + СШ.
Смотрите также:
| Термодинамические функции | Теория теплоемкости твердых тел |
| Применение квантовой статистики к осциллятору. Формула Планка для его средней энергии | Колебания одномерной цепочки упругосвязанных частиц |

