Оглавление:




Давление пара и энтропия испарения
- Давление пара II энтропия испарения Начиная с формулы (4.3), если она рассматривается (ДС \ (=-5,<0НД » (M-Щ 01 / т, п Где sv и$ cov-молярная энтропия газовой и конденсированной фаз.
Когда газ считается идеальным, согласно (10.10) С. ст Р =, — отн. ЕД. п. (14.15) Игнорирование влияния давления на конденсированную фазу、 5K0 «D = st. Kovd(7′) (14.16) (См. 12.27).Сделать Конд по разности Р — aest и Конд по разности ВЧ-ГКО}и Аджи. А = — А€Н + TAesI-10 в п. (14.17) В равновесии A = 0 и, Ач, Афтст… Ло. Заметим, что Aes * — энтропия испарения при P = 1 атм и совпадает с изменением стандартной энтропии (A * s°). поэтому при T = 298,2°K Аджи(298.2) ыть(298.2)1» р- + 。 (14.1 у)
Здесь мы приводим уравнение давления пара конденсированной фазы к виду, который более четко подчеркивает значение энтропии испарения. Людмила Фирмаль
Эта формула аналогична (10.52). Если T существенно не отличается от 298,2°К, то значения Aek(298,2) и A (298,2) могут быть приблизительно равны значениям этих величин при температуре T, и поэтому достигают приближенного уравнения. 1У п =(208.2) А ^ Т(298.2)_ ИГ Р Форма этого уравнения та же, что и (14.8), но константы имеют определенный физический смысл.
Если вы хотите учесть изменения в AJt из-за температуры, вы должны сделать точно то же самое, что сделано в разделе VII,§ 8. Энтропия стандартной » газовой фазы и конденсированной фазы часто unknown. In в таких случаях приближенным расчетом можно оценить величину a ^ t при атмосферном давлении, используя 1 из грубых правил.
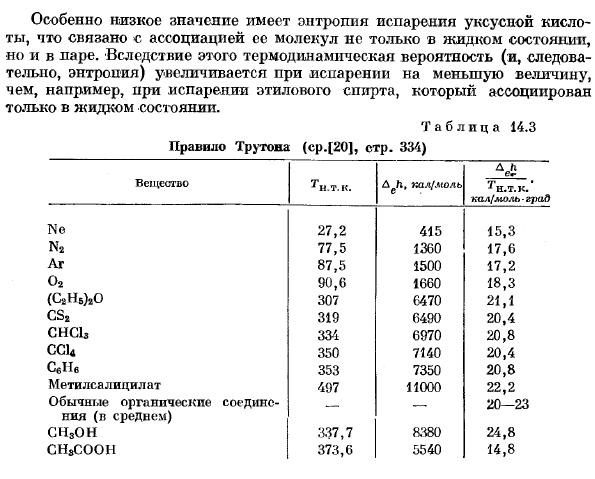
Наиболее важным из них является закон Торонто 1, а энтропия испарения при нормальной температуре кипения (если жидкость и пар сосуществуют при давлении 1 атм) составляет около 20 кал! Мол * град、 — ^r — » 20 кал / моль * град. (14.21) Я делаю это. С тех пор Данные, которые показывают это правило, можно найти в таблице. 14.3.As вы можете видеть, что правило истины обеспечивает только порядок величины энтропии испарения 2. Энтропия испарения уксусной кислоты особенно низка в Заппе, что связано не только с жидким состоянием, но и с Ассоциацией молекул в vapor. As в результате этого термодинамическая вероятность (а следовательно, и энтропия) возрастает, когда он испаряется в меньшем количестве, чем, например, связанное с ним испарение этилового спирта только в жидком состоянии.
- Таблица 14. 3 правила Толтона (ср. [20], С.) Вещество — это Тай. L h вперед, cal / mol C•T * 1 N. T. хорошо. кал / моль-грао Нет, 27.2 415 15.3. П2. 77. 5 1360. 17.6. АГ 87.5 1500 17.2 большие изображения: лучшая цена Онлайн для с быстрой доставкой!!! (C * HB), 0 307 6470 21.1 Почва* 319 6490 20,4 ССР 334 6970 20,8 SSC 350 7140 20.4 S6Nv 353 7350 20.8 Меряли lsalicy широта 407 11000 22.2 Общие органические соединения.20-23. (Обычный) СН3ОН 337.7 8380 24.8
В соответствии с правилами CHsCOOH 373.6 5540 14.8 Torton, необходимо упомянуть версию, предложенную Gilde brand, в которой энтропия пара берется не при температуре кипения, соответствующей тому же давлению, а при температуре, соответствующей тому же понятию = p / RT L. правило Гиля-дебрапа в целом более точно, чем правило Трутона.
Заметим, однако, что эти правила не следуют соответствующей теореме о состоянии, поэтому энтропия испарения равна при равной температуре падения. Людмила Фирмаль
Смотрите также:
Решение задач по термодинамике
| Фазовые превращения. Уравнение Клаузиуса — Клаперона. | Давление пара и свободный объем |
| Постоянные давления пара и химические постоянные | Энтропия плавления |

