Оглавление:


Реакции комплексообразования кондуктометрического титрования
- Реакция комплексообразования Титры катионной проводимости могут использовать растворы различных кислот и оксикислот (щавелевая кислота, винная кислота, лимонная кислота и т. Д.), Комплексон и другие лиганды в качестве титрантов.
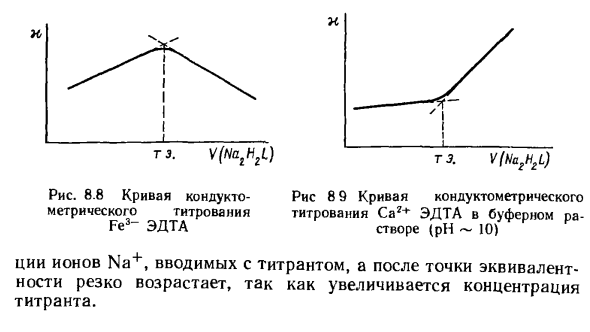
- Наиболее важным на практике является титрование электропроводности катионов дизамещенной солью этилендиаминтетрауксусной кислоты (ЭДТА). Например, титрование Fe3 + раствором ЭДТА (Y4 ~) будет продолжать реакцию Fe3 + + H2Y2- = FeY ~ + 2H +
В результате высвобождаются ионы H + и увеличивается проводимость раствора. Людмила Фирмаль
- Поскольку высвобожденные ионы H + связаны анионом H2Y2_, после точки эквивалентности проводимость раствора уменьшается H + + H2Y2 «= H3Y ~ Такая кривая титрования показана на рисунке. 8,8. Кривая титрования буферного катиона немного отличается (рис. 8.9). В этом случае высвободившиеся ионы H + взаимодействуют с протоноакцепторным компонентом буферной системы и поэтому не вносят столь существенного вклада в электропроводность раствора.
Рис. 8.8 Кривая электропроводности — Рис. 8 Кривая титрования для измерения электропроводности титрования Cag + ЭДТА в 9-буферном растворе ЭДТА ra-Fe3 (pH-10) По мере увеличения концентрации титранта количество ионов Na +, введенных с титрантом, быстро увеличивается после точки эквивалентности.
До эквивалентного значения электропроводность раствора слегка увеличивается, что в основном связано с увеличением концентрации. Людмила Фирмаль
Смотрите также:
Решение задач по аналитической химии
| Реакции кислотно-основного взаимодействия | Реакции окисления-восстановления кондуктометрического титрования |
| Реакции осаждения кондуктометрического титрования | Высокочастотное титрование |

