Оглавление:










Задачи по комплексометрическому тетрованию
- Задание I. Какова масса смеси, содержащей 25% KBg, 65% KCI и 10% KNO3? Его следует использовать для анализа так, чтобы титрование проводилось на 20,0 мл 0,1. Hg (N0,4) 2 (/ target.> = ‘/ 2)? Для xg возьмите образец материала, собранного для анализа, затем соберите количество материала KBg и KS! Будете ли вы: (1M) DG-25 LG-65 / I (KV g) = ,, tA .. ,,, n-: n (KC1) 100 M (KBr) • » | -. * <НЕТ>>. >
- Где ItHr .- (NO ”) .-) = ——— rTvwT —— • Работникам. хорошо * -25 x • 65 N <> «) * H ‘(НцлКО.Ь 100 M (KBr) 1 (H) M (KCI) «» 1000 Подстановка числа приводит к: -25 +, ~ ° .’120; х-0,1848 г 100-119,0 ‘100 74,55 1000 2. Растворите порцию 1.703 г веса AI (N03) 3 * 1H2O и добавьте 200.0 мл раствора и избыток Na-jMg раствора ЭДТА до 20.00 мл. 17,45 мл 0,02507 М ЭДТА было использовано для титрования высвобожденного Mg2 +. Рассчитать массу Соотношение Al (%) (NO0.
«В первом препарате сравните с теорией AI (NO:»). Людмила Фирмаль
Количество / I (EDTD), затраченное на титрование, равно / f (MjT ^) для реакции и реакции вытеснения. Mg EDTD ‘+ LH! = D1 EDTD + Питание Количество алюминия n в образце (L114): p (EDTD) = / I (Mg-41- / cAG «). По результатам титрования s (EDTD) G (EDTD) „IDTA) = -Tooo» ——-
Поэтому, учитывая разбавление, массовая доля соленой воды {%) (Al (NO- «)»): «AI.NO.W = CHEDTATEDTA! M (AI (Na,« MW »И) 1000 20,0 1,703 0,02507 ■ 17,45 21; ш. 20O0. 100 1000 ’20 .00 1,703 Соль AI (NOt))> 9NgO AUNOijj Теоретическое сравнение содержания. Равные отношения М (АЦМО.г) <) 100 213,0-100М (Д1 (Ж) 1), -9Н.О) «= ж» 375,13 ~~ Содержание анализируемой воды выше, чем у гидрата 9 кристаллов воды. 3.
При анализе сточных вод 25,00 мл 0,02 М BaCl1 (/ (= 0,9816)) добавляли к 100,0 мл образцу при нагревании. Рассчитать 0,02 М EDTD 00 мл (/ (= 1,018). Концентрация ионов SO | ~ (г / л). Эквивалентная точка *, отношение «(SOf) == n (BaClj) -n (EDTD). Представляет количество эквивалентов SO. , ViS1? А данные, приведенные в проблемном состоянии, EDTD и концентрация SO’i, выражены в х г / л: dg-> 00 <(BaBb) / C-V (плохо), r (EDTD) K-V (EDTD) 10 (NS (SOS «) 1000 1000 g (плохо) KV (BaC1 «) -g (EDTD) K-V (EDTD) <с_2. 1000 .VI (ML) 1000 • * 1 ‘100,0
Подставив номер, вы получите: 0,02-0,9810,25,00-0,02-1,018-17,00 . 1000 н; UVTTT = 0,1 ZOO г / л 1000 100,0 4. Сколько металлического цинка нужно растворить в H2SO4? Как приготовить 250,0 мл 0,01 М раствора ZnSO? Ответ: 0,16 г. 5. Определите молярную концентрацию, титр и титр измерительного раствора 7d / рабочего раствора A в соответствии с результатом титрования образца установленного вещества C.
В варианте рабочей жидкости L установлено вещество C обнаружено вещество Количество по рецепту, мл фаркоп, г 1 HgfNOsh 19,31 NaCl 0,0610 кВтч 2 1Cha2N2EDTA 18,46 Zn 0,0131 Co 3 Na2H2EDTA 20,15 CaCO3 0,1035 CaO Ответ: I) 0,02703; 0,008774; 0,006433; 2) 0,01085; 0,004039; 0,0006394; 3) 0,05132; 0,01910; 0,002878. 6. Какую массу Co (N0.3) 2’bNgO следует использовать для анализа с содержанием примесей около 7%?
Следовательно, для титрования требуется около 10,0 мл 0,1 М ЭДТА. Ответ: 0,31 г. 7. Для приготовления 100,0 мл раствора на титрование 20,00 мл расходуется 20,00 мл 0,2000 М ЭДТА, вес металлического цинка которого должен составлять 99,99%. Ответ: 1,31 г. 8. Для анализа следует использовать массу силиката, содержащего около 20% AI2O3.
Поэтому после оттаивания, надлежащей обработки образца и добавления избытка NajMg ЭДТА титруют алюминий с помощью 10,0 мл 0,1 М ЭДТА. Ответ: 0,25 г. 9. Рассчитайте вес смеси, содержащей 45,00% KBr, 48,00% NaBr и 7,00% посторонних примесей, так что во время титрования ртути расходуется 21,25 мл 0,04966 n. Hg (N03) 2 (/ \ nn = 7r). Ответ: 0,1267 г. 10.
Какова масса ртути в 250 мл раствора? Вы добавили 25,00 мл 0,01000 М ЭДТА к избытку 50,00 мл и затем титровали 10,50 мл 0,01000 М MgSO 4? Ответ: 145,4 мг. 11. Раствор соли кальция и магния разбавляли до 100,0 мл водой. 18,020 мл 0,01020 М ЭДТА расходовали в аликвоте 20,00 мл титрования Eriochrome Black T и 8,22 мл ЭДТА расходовали в той же аликвоте титрования с муреоксидом.
Какова масса Ca и Mg в исходном растворе? Ответ: 0,0168 г Ca; 0,0127 г Mg. 12. Если на титрование 20,00 мл расходуется 20,05 мл 0,1215 М AgNO.3 и помутнение не исчезает, какова масса KCN в растворе на 500,0 мл? Соответственно, эквивалент молярной массы M (2KCN) используется для учета образования комплекса Ag (CN) 2 в эквивалентной точке. Ответ: 7,932 г. На титрование 20,00 мл раствора NiCh расходуется 21,22 мл 0,02065 М ЭДТА.
Определите концентрацию (г / л) раствора соли никеля. Ответ: 2,840 г / л. 14. Определите концентрацию раствора Bi (N03) 3 (г / л) при использовании 17,26 мл 0,06905 М ЭДТА для титрования 20,00 мл. Ответ: 23,54 г / л 15. Титрование 20,00 мл раствора ртути (избыток № gA ^ EDTA и N 0 ^ 2 после добавления процесса реакции вытеснения) Mg EDTA2 «+ Hg / + = Hg EDTA2 + Mg * + 0,055 ЭДТА (К = 1,055) использовали в 19,85 мл.
Рассчитайте концентрацию раствора (г / л) H & (MOH) 2-Ответ: 16,99 г / л. 16. Для титрования использовали 25,00 мл раствора Ba (NO. ^ Na2Mg3ilTA, 18,05 мл 0,1 М ЭДТА (/ (= 0,9878)). Концентрация исследуемого раствора Ba (г / л) Рассчитать (№ 0,3) 2. Ответ: 18,64 г / л. 17. После осаждения в виде NaZn (1Ny) s (CH3COO) * — • 6H2O полученный осадок отделяют и растворяют в 20,85 мл цинка 0,01 М ЭДТА (/ (= 0,9194)? 441 мг. 18.
При измерении железа в объеме 200,0 мл сточных вод железо окисляется до трехвалентного, солится аммиаком, отделяется от раствора, растворяется в HCl, а затем титруется 5,14 мл 0,005 М ЭДТА. (/(=1.101). Общая концентрация (мг / л) железа в воде Ответ: 7,90 мг / л. 19. Стандартный раствор хлорида магния готовили растворением 0,1065 г чистого оксида магния в соляной кислоте, раствор разбавляли и доводили до 250,0 мл водой в мерной колбе.
Раствор ЭДТА стандартизировали, используя объем образца 20,00 мл приготовленного раствора, и титровали при рН 10,0. Для титрования потребляли 19,75 мл раствора ЭДТА. Рассчитайте концентрацию (моль / л) раствора ЭДТА. Ответ: 0,01070 моль / л 20. До 10,0 мл раствора NiCl? Добавляли дистиллированную воду, аммиачный буфер и 20,0 мл 0,01085 М раствора ЭДТА.
Избыток ЭДТА титровали 0,01292 М MgCl2, и для титрования использовали 5,47 мл. Nici? Рассчитайте начальную концентрацию (г / л) раствора. Ответ: 1897 г / л. 21. При анализе пробы промышленных сточных вод объемом 100,00 мл ионы сульфата бария осаждаются в растворе хлорида бария, осадок сульфата бария фильтруется, промывается и растворяется в 30,00 мл 0,025 М ЭДТА (/(=1.001) Ml 0,025 M Хлорид магния (/ (= 0,9997).
Определить концентрацию ионов SO4 (мг / л). Ответ: 361,4 мг / л. 22. Чтобы измерить содержание сульфат-иона в минеральной исходной воде, добавьте 25,00 мл 0,1115 М BaCl к 150,0 мл воды и отфильтруйте осадок BaS04 с аммониевым буфером, содержащим комплексный экстракт магния. Титрование в дополнение к смеси 14,00 мл 0,01242 М ЭДТА. Рассчитайте концентрацию сульфат-иона (мг / л). Ответ: 67,16 мг / л. 23.
При определении карбонатной жесткости титрования 200,0 мл воды потребляли 10,25 мл 0,1 М HCl (К = 0,9845). При определении общей жесткости на 100,0 мл той же воды потребовалось 15,12 мл 0,05 М ЭДТА (К = 0,8918). Рассчитайте карбонатную, общую и постоянную жесткость воды (ммоль / л). Предположим, что молярная масса, эквивалентная M2 +, равна M C / vM2 . Ответ: 5,05, 13,48, 8,43 ммоль / л. 24.
Если для титрования раствора, полученного из образца весом 0,5569 г, использовали 21,20 мл 0,2500 н, рассчитайте массовую долю промышленных отходов бромида натрия. Hg (NC> 3) 2 (f, q = 1/2). Сравните с теорией. Ответ: 76,04%, теория 77,66%. 25. Для измерения хлорида образец кальцинированной соды весом 1,652 г растворяли в воде и объем доводили до 100,0 мл.
Образец титровали после нейтрализации азотной кислотой и потребления 18,38 мл 0,01 н. С 20,00 мл полученного раствора. Hg (NC> 3) 2 (/ «q = ‘A) (K = 1,075). Рассчитайте массовую долю хлорида (%) по отношению к NaCl в исследуемом образце. Ответ: 3,49%. 26. 100,0 мл раствора готовили из 1,099 г BaCl2-2H20 и Na2MgCl2 TA добавляли к 20,00 мл этого раствора. 17,65 мл 0,05085 М ЭДТА было израсходовано, титруя полученную смесь.
- При титровании бария в присутствии магния рассчитывают массовую долю (%) BaBb3 в образце, предполагая, что n (Ba) = n (EDTA). Сравните рассчитанное значение с теоретическим значением ВаС12-2Н> 0. Ответ: 85,00%; теория 85,25%. 27. Взвешивали 0,2043 г для определения количества лантаноида в фосфорсодержащем материале. После растворения и отделения интерференционных ионов раствор титровали из 1,82 мл микробюретки, содержащей 0,01078 М ЭДТА, содержащей ксиленол.
Ответ: 1,33%. 28. Какова массовая доля (%) свинца в тройных сплавах Pb-Na-K? Если растворено 2,85 г его веса и раствор разбавлен до 250,0 мл, то 25,00 мл этого раствора титруют до 12,28 мл с 0,128. М ЭДТА (/ С = 1,086) и ксиленоловый апельсин. Ответ: 95,78%. 29. 250,0 мл раствора готовили растворением 0,7634 г образца HgfNChV ‘ H2O, к которому добавляли 25,00 мл 50,00 мл 0,01007 М ЭДТА.
Рассчитайте массовую долю (%) количества лантаноидов в образце с лантаном. Людмила Фирмаль
Титруйте избыток ЭДТА, используя 23,83 мл 0,01178 М ZnSCX, рассчитайте массовую долю (%) Hg (НЧ) 2 в образце и определите количество молекул воды в кристаллогидрате. Я сделал Ответ: 94,73%; я = I 30. Обработать порцию удобрения массой 2,503 г минеральной кислотой, Раствор доводили до 250,0 мл и осадок отфильтровывали. 50,00 мл фильтрата помещали в мерную колбу объемом 100,0 мл, объемом 25,00 мл и объемом 0,1 МБ.
В результате взаимодействия ортофосфорной кислоты и Bi (N03) .i образовался осадок BiPO * по реакции Bi (NO,) v 4-MiPOi BiPO *. + 3к я НЕТ < Это снова было отделено фильтрацией. Избыток 0,05 М ЭДТА (AG = 1,001) иона Bi15,00 мл титровали в присутствии фиолетового илокатехола в 50,00 мл фильтрата. Определите массовую долю (%) P2Og в удобрении. Ответ: 13,41%. 31.
Процесс очистки теплового оборудования с помощью хелатирующего агента дает раствор, содержащий железные и медные кометы. Когда образец такого раствора объемом 50,00 мл нагревали для разложения металлокомплекса и комплексных соединений, его обрабатывали концентрированной HNO.i и остаток разводили до объема 100,0 мл в мерной колбе.
В 25,00 мл разбавленного раствора железо осаждали аммиаком, осадок гидроксида отделяли, растворяли в соляной кислоте и титровали с помощью ЭДТА, содержащей сульфосалициловую кислоту. После отделения гидроксида железа фильтрат аммиака собирали и титровали раствором EDTA, содержащим индикатор PAR, для определения содержания меди.
Результаты титрования железа и меди приведены в таблице. Титрование меди железо титрование опции V (ЭДТА), мл с (ЭДТА), Y • V (ЭДТА). мл с (ЭДТА). моль / л 1 12,18 0,01021 16,11 0,01021 2 10,92 0,01095 14,15 0,01095 3 11,62 0,02516 15,81 0,02516 4 15,41 0,02498 19,14 0,02498 5 12,62 0,01203 16,17 0,05013 6 10,35 0,01142 15,26 0,05212
Рассчитайте концентрацию железа и меди (г / л) в исследуемом растворе. Ответ: I) 0,5556 г / л Fe; 0,8362 г / с Cu: 2) 0,5342 г / л Fe; 0,7877 г / л Cu; 3) 1,306 г / л Fe; 2,022 г / л Cu; 4) 1,718 г / л Fe; 2,413 г / л Cu; 5) 0,6460 г / л Fe; 4,136 г / л Cu; 6) 0,5281 г / л Fe; 4,043 г / л Cu 32. Рассчитайте массовую долю (%) CaCOj и MgCO в известняке.
Если после растворения 1000 г получают 100,0 мл раствора, расходуют 19,25 мл 0,5140 М ЭДТА с титрованием 20,00 мл, чтобы определить количество Са и Mg. В другом образце (20,00 мл) проводят титрование с Са Для того же раствора ЭДТА было израсходовано 6,25 мл. Ответ: 16,10% CaCO3, 28,15% MgCO. 33. Часть удобрения весом 4,026 г разложилась под действием минеральной кислоты, в результате чего объем раствора составил 250,0 мл.
После удаления нерастворимого остатка образец фильтрата объемом 50,00 мл нейтрализовали NaOH до появления помутнения и добавляли ацетатный буфер до рН 4,6, чтобы довести объем до 250,0 мл. Для определения кальция раствор получают из 25,00 мл образца Титрование 10,02 мл 0,0512 М ЭДТЛ, содержащего флуорексон. Образец такого раствора титровали темно-синим хромом, используя 18,14 мл того же раствора ЭДТА для определения общего содержания кальция и магния.
Расчет! Массовая доля (%) CaO и MgO в удобрении. Ответ: 35,75% CaO, 20,80% MgO. 34. В процессе анализа каолина образец весом 0,5108 г сплавляли с HgCO3 и .Ma ^ Cb, и расплав растворяли в разбавленной HCl до объема раствора 250,0 мл. Образец объемом 100 мл нейтрализовали, добавили уротропин, осажденную кремниевую кислоту отфильтровали и промыли теплым раствором уротропина.
Фильтрат и промывные жидкости титровали 10,16 мл 0,005040 М ЭДТА, содержащего индигокармин в присутствии 20% КОН. Рассчитайте массовую долю (%) CaO в каолине. Ответ: 1,41%. 35. 250,0 мл раствора готовили из образца массой 3,924 г, содержащего свинец, магний, цинк и нейтральные примеси. Вы добавили цианид в 25,0 мл образца раствора, чтобы связать цинк с комплексом Zn (CN)?
Оставшийся в растворе магний и свинец титровали 20,42 мл 0,05037 М ЭДТА. Затем свинец маскировали тем же раствором, содержащим 2,3-димеркаптопропанол, и полученный EDTA4 титровали 18,01 мл 0,01012 DA MgCl. Формальдегид был добавлен в тот же образец, чтобы разоблачить цинк. Zn (CN) ~~ + 4НСОН + 4Н? 0 = Zri2i + 4HOCH * CN + 4 () Н ~ Высвобожденный цинк титровали 15,07 мл 0,05037 ДА ЭДТА.
Рассчитайте массовую долю (%) свинца, магния и цинка в образце. Ответ: 9,87% Pb; 5,21% Mg; 12,65% Zn. 36. После растворения в азотной кислоте взвешивали 4,012 г латуни, отделяли осадок метастанновой кислоты и готовили 500,0 мл раствора из фильтрата и промывочного раствора. 49,29 мл 0,025 М ЭДТА (/ (= 0,9613) было использовано для общего титрования свинца, цинка и меди в пробе 10,00 мл.
В другой порции раствора по 25,00 мл медь представляла собой тиосульфат натрия В масках 21,33 мл того же раствора ЭДТА потребляли с цинком, а в третьей части 100,0 мл раствора медь и цинк маскировали цианидом, а 10,26 мл той же концентрации расходовали на титрование свинца. Определите массовую долю (%) латунного компонента 6,37% Pb; 14,70% Zn; 37.
Часть для взвешивания феррита, состоящая из RegO3, NiO и A1-, 0,5192 г унции растворяли, а железо экстрагировали и разделяли эфиром в форме купроната, чтобы приготовить 100,0 мл раствора. Чтобы определить количество никеля и алюминия в пробе 20,00 мл, добавили 50,00 мл 0,05 М ЭДТА (К = 0,9815). 18,12 мл 0,05 М ZnSO <с титрованием (К-1,071).
Затем тот же образец маскировали алюминием KF и использовали 16,48 мл того же раствора для титрования высвобожденного ЭДТА. Вор Z11SO4. Определяет массовую долю (%) оксида в феррите. Ответ: 13,44% Fc203; 43,23% NiO; 43,33% L1203. 38. Раствор, полученный из взвешенной части феррита состава Fe203-BaO, имеющего массу 0,3822 г, пропускали через колонку, снабженную анионообменной смолой, для отделения железа.
Полученный раствор нейтрализуют до рН 10,0, добавляют 25,00 мл 0,025 М ЭДТА (К = 0,9816), избыток расходуют 20,92 мл и 0,02 М MgCl2 (/(=1,096) с эриохромным черным Т-индикатором. ) Рассчитайте массовую долю (%) оксида в феррите, титрованном в ответе: 6,18% BaO, 93,82% Fe203. 39.
Раствор, приготовленный из взвешенной порции 0,6018 г феррита состава Fe203-NiO-СОО, пропускали через сильноосновную анионообменную смолу, и для разделения элементов использовались следующие элементы. Выщелачивание кобальта и 1 М HCl-железа. В результате разделения получали ионный раствор, титрованный комплексным раствором.
В этом случае 19,53 мл 0,05 М ЭДТА (/(=1,102) было потрачено на титрование никеля, а 4,81 мл 0,01 М ЭДТА (К = 0,9996) было затрачено на титрование кобальта. %) Определение содержания оксидов в феррите Ответ: 13,36% NiO; 0,59% CoO; 86,05% Fe203. 40. Если было проведено 20 титрований этого образца в присутствии ксиленолового оранжевого при рН 1,0, объем анализируемого образца из раствора, содержащего 0,67 г / л свободного комплексона III и определенное количество железа, был уменьшен. вычислить.
0 мл 0,01 М Bi (N03) 3-ответ: 100,00 мл. 41. Какова масса препарата, содержащего 25% внутрипросветного Ci2Hi2N20.i (М = 232,24 г / моль)? Следует анализировать по следующей схеме: После растворения образца в щелочном растворе просвет нейтрализуют путем добавления Hg (Ci2HiiN203) 2 уксусной кислоты, 50,0 мл 0,01 М Hg (C! 04) 2, полученную смесь доводят до объема 100,0 мл и осаждают
Фильтруют материал, берут 20,0 мл образца из фильтрата, добавляют к нему избыток Na2Mg ЭДТА и титруют 10,0 мл 0,005 М ЭДТА с Eriochrome Black T в аммониевом буферном растворе. Ответ: 0,46 г. 42. Использовать титрование 50,00 мл образца при рН 4 для определения свободного комплексона III в присутствии комплексов с железом и медью в растворе, полученном путем промывки поверхности нагрева котла от солевых отложений Тогда … индикатор PAR.
Результаты титрования для нескольких образцов приведены в таблице. Образец HCiiSOO. <(CuSO,). Образец V (C.uSO «). S (CuSOi). мл моль / л мл моль моль / л 1 10,15 0,05081 3 20,18 0,01019 2 IG.4I 0,02542 4 11,47 0,2112 Рассчитайте концентрацию свободного .MagNzZDTA (г / л) в исследуемом образце. Ответ: 1) 3,486 г / л; 2) 2 759 г / л; 3) 1,383 г / л; 4) 1,630 г / л. 43. Для контроля за ходом очистки солевых отложений на поверхности нагрева котла содержание свободного комплексона III в присутствии комплекса железа определяли с помощью комплексона.
Поэтому серию образцов объемом 50,00 мл непрерывно титровали и подкисляли до pH I азотной кислотой, используя раствор нитрата висмута в присутствии ксиленолового оранжевого в качестве титранта. Результаты титрования приведены в таблице. Образец 1 Образец 2 Образец 3 г (Bi (NOx) с). Y (BMMOE), c (Bi (NO,).). ^ (Bi (NOi) j), с (Bi (NO,),). мл моль / л мл моль / л мл моль / л I. 19.50 0.002009 9.65 0.002009 4.82 0.002009 II. 12,18 0,005162 10,49 0,005102 5,11 0,005162 III. 16,91 0,002517 14,12 0,002517 0,84 0,002517
Следуйте процессу промывания, рассчитав концентрацию (г / л) свободного комплексона № 2N2EDTA в трех последовательных образцах. Ответ: I. 1) 0,2634 г / л; 2) 0,1304 г / л; 3) 0,0651 г / л; II. I) 0,4228 г / л; 2) 0,3641 г / л; 3) 0,1774 г / л; III. 1) 0,2862 г / л; 2) 0,2390 г / л; 3) 0,0142 г / л. 44. Если в ходе анализа осаждается Cu [C6H5CH (OH) COO] 2, какова масса миндальной кислоты SbH5CO (OH) COOH M = 304,32 г / моль в образце? Осадок растворяли и титровали 20,25 меди (II). 0,01000 М ЭДТА мл в присутствии мю-оксида.
Ответ: 0,0616 г. 45. CdCl2 в спирте добавляли к 10,00 мл испытуемого раствора, содержащего пиридин. Выпавший осадок Cd (C5H5N) 2Cl2 отфильтровывают, растворяют и титруют с помощью 15,25 мл 0,01 М ЭДТА (A ‘= 0,9918), содержащего Eriochrome Black T в аммониевом буферном растворе. Рассчитайте концентрацию (г / л) пиридина в маточном растворе.
Ответ: 2,393 г / л. 46. Порцию лекарственного средства, содержащую 0,5200 г хинидид-локлонда после растворения, разбавляли водой до 50,00 мл. Из образца 20,00 мл раствора в ацетон-бензольной среде осаждали Cu (CgOH ^ L ^ Cb- (CH3COCH3) г. г. Осадок отфильтровывали, растворяли в аммиаке и 0,05000 М меди в присутствии муроксида.
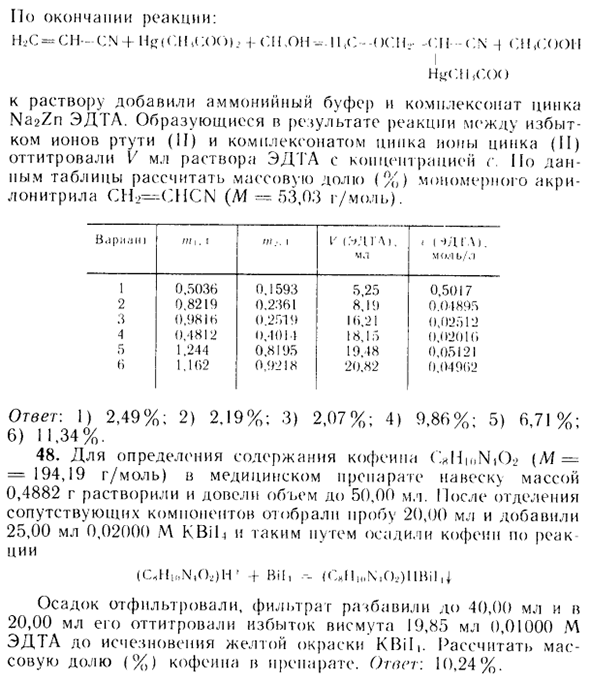
Титрование с помощью ЭДТА и расход 10,75 мл. Рассчитайте массовую долю (%) C20II21 N2O2 хинина (М = 324,42 г / моль) в препарате. Ответ: 83,83%. 47. Часть образца Ni, состоящего из акрилонитрила и его полимера, растворяли в метаноле, содержащем BFsO (Ns) * в качестве катализатора. К раствору добавляли Т-2 г Hg (CH3COO). В конце реакции: НГС «СН-CN-f Hg <р. | LtC <X)) .. + СН.ОН» 11,0 • OSI — С11С \: ом.сун Я Аммонийный буфер и цинковый комплекс Na2Zn EDTA добавляли к раствору.
Ионы цинка (II), образовавшиеся в результате реакции между избытком ионов ртути (II) и холексоната цинка, титровали V мл раствора ЭДТА в концентрации с. Рассчитайте массовую долю (%) мономерного акрилонитрила CH2 — QICN (A1 = 53,03 г / моль) согласно таблице. B.fl.ip nit 1 метр 1 л ‘1.HHGL. «<IDGL1. мл М <«.- ib /, я 1 0,5036 0,1593 5,25 0,5017 2 0,8219 0,2361 8,19 0,01895 3 0,9816 0,2519 1 (и.21 0,02512 А 0,4812 0,101) 18,15 0,0201 (я 5 1,244 0,8 IDS 19,18 0,05121 6 1,162 0,9218 20,82 0,04962
Ответ: 1) 2,49%; 2) 2,19%; 3) 2,07%; 4) 9,86%; 5) 6,71%; 6) 11,34%. 48. Для определения содержания кофеина в препарате (‘HmNiO? {M- = 194,19 г / моль) весили 0,4882 г и доводили объем до 50,00 мл. После отделения сопутствующих компонентов отбирали образец объемом 20,00 мл и добавляли 25,00 мл 0,02000 М K Bib для осаждения кофеина таким образом.
(C.Hii.N.O *) ”-f Bill 10 * 11 ,,, N, 0 *) и ноль 1J Осадок отфильтровывали, фильтрат разбавляли до 40,00 мл и избыток висмута, равный 19,85 мл 0,01000 М ЭДТА, титровали при 20,00 мл до исчезновения желтого цвета KBili. Рассчитайте массовую долю (%) кофеина в составе. Ответ: 10,24%.
Смотрите также:
Решение задач по аналитической химии
| Индикаторы | Аргентометрия |
| Практическое применение | Кривые титрования в аргентометрии |

