Оглавление:



Особенности строения атомов металлов побочных подгрупп
- Структурные особенности вторичных подгрупп атомов металлов В отличие от атома металла основной подгруппы, в атоме металла боковой подгруппы следующий электрон находится не снаружи, а находится на 2-м энергетическом уровне от последнего, и количество электронов пополняется от 8 до 18(I, с. 112).
- Так, например, скандиевая боковая подгруппа Sc (№ 21)в первом элементе. Следующий 21-й электрон помещается от последнего до 2-го энергетического уровня. + 2iSc 2, 8, 9, 2 Что касается последующих элементов, то на последнем-2-м энергетическом уровне скандия число электронов последовательно увеличивается с 9 до 18.
На последнем уровне сохраняются 2 электрона (кроме Cr и Cu). Людмила Фирмаль
Последний Элементы вторичной подгруппы 4-го цикла-электроны Zn по уровню энергии распределяются следующим образом: + 3озн 2, 8, 18, 2 Среди металлов подгруппы Cr является наиболее важным. Местоположение хрома в периодической системе и строение его атомов. Хром лидирует в боковой подгруппе группы VI. энергетические уровни атомов хрома и расположение электронов по орбиталям являются: + 2 * Cg2ë,8ё,13ё,1ëIs2 2s22рб3s2Зр6__3d5bs1 24Cg(W [Y1ShSCH ISHShBZHSh
Согласно закону, регулирующему заполнение энергетического уровня и подуровня (орбитали), атому хрома на 4-м энергетическом уровне (подуровне s) требуется 2 электрона. Однако 2 из 1 электрона перемещаются на 3-й энергетический уровень по незаполненной D-орбите. Это явление наблюдается в атомах многих элементов и называется»провалом»электронов.
Атомы хрома имеют 6 неспаренных электронов (см. Рисунок).Это объясняет, что хром может показать степень окисления от+1 до+6. Наиболее важными являются соединения хрома со степенями окисления+ 2,+ 3 и+ 6. Ответьте на вопросы 1 и 2 (стр. 121). Быть внутри nature. In в нашей стране наиболее распространенной хромовой рудой является хромовая железная руда, или железная хромовая железная руда FeO * Cr203.
Оксид хрома (III) Cr203 и некоторые другие соединения хрома также присутствуют в природе. Мы получили ваши отзывы. Когда хромовая железная руда сильно нагревается углем, хром и железо уменьшаются. «2 +3 ’0 0 0 +2 FeO * Cr203 + 4C 4«2Cg + Fe + 4C В результате этой реакции образуется сплав хрома и железа-феррохром. formed.
- To получают чистый хром, его восстанавливают из оксида алюминия. О Компании Tz / + Cr2Os + равен 2ai-я А1203 + 2Cg Физические характеристики. Хром-это серовато-белый металл, блестящий на вид, похожий на железо. Его плотность составляет 7,19 г / см3, а температура плавления-1890°С. Отличительной особенностью хрома является его высокая твердость(с. 87).
Это объясняется тем, что в металлической сетке имеется 1, 6 относительно свободных электронов на электрон, которые относительно малы по отношению к ионам хрома. Металлический хром может «резать» стекло. Химическое свойство. Поверхность хрома покрыта очень тонким (и поэтому прозрачным) оксидом film.
It очень устойчив химически, и даже кислоты разрушают его без труда. Людмила Фирмаль
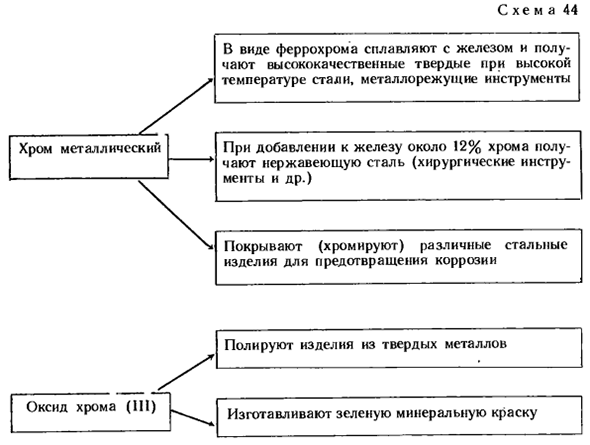
Благодаря этой пленке хром является одним из самых коррозионно-стойких металлов. Даже при высокой влажности она не меняется совсем. Соляная и серная кислоты, разбавленные хромом, начинают реагировать через некоторое время (после разрушения пленки). Cr + H2S04 -» — CrS04 + * H, f Азотная кислота пассивирует хром(иммобилизирует оксидную пленку). Применение хрома показано на схеме 44. Вопросы 3 и 4 (стр. 122), задача 1(стр. 122).
Смотрите также:

